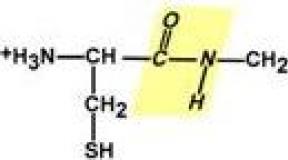
Какие бывают основания в химии. Физические и химические свойства оснований. Особые свойства оснований
ЦЕЛИ УРОКА:
- Образовательная : изучить основания, их классификацию, способы получения и свойства.
- Развивающая : способствовать закреплению знаний о классах неорганических соединений, развить и углубить представление о гидроксидах.
- Воспитательная: привить интерес к предмету химии, соблюдать правила ТБ при обращении. с основаниями (щелочами).
Оборудование: мультимедиа, компьютер,задания, ПСХЭ, таблица растворимости, щелочи, хлорид меди, индикаторы.
Ход урока
Организационный момент. Проверка домашнего задания.
I. Мотивация урока.
Учитель: Чем можно заменить шампунь, мыло?
Щелок - это консистенция из золы, настоянной на воде. Щелок в экопоселении используется для купания и стирки. В отличие от различных продающихся в магазинах моющих средств, это полностью природное вещество! Мытье волос золой - одно из старинных средств, применявшихся нашими прабабушками. Берёзовая зола - обладает щелочными свойствами вследствие содержания поташа.
II. Объявление темы урока. Целеполагание.
Учитель.Тема урока: "Основания, их классификация и свойства".
III. Актуализация знаний.
Гидроксиды - соединения, состоящие из атомов металлов и гидроксид-ионов.
Основания с точки зрения ТЭД - это электролиты, которые в водных растворах диссоциируют на катионы металла и гидроксид - анионы.
NaOH <-> Na + + OH -
Ba(OH) 2 <-> Ba +2 + 2OH -
IV. Изучение нового материала. Осознание и осмысление.
Учитель. Изучим классификацию оснований:
а) По растворимости в воде: растворимые и нерастворимые
б) По кислотности: однокислотные и двухкислотные
в) По степени электролитической диссоциации: сильные и слабые
Если в соль добавить щёлочь,
На пробирку посмотреть -
Синий выпадет осадок -
Основания- гидроксида меди II.
- Fe(OH) 3 красно-бурый,
- Сr(OH) 3 - cеро-зеленый,
- Co(OH) 2 - темно-фиолетовый,
- Ni(OH) 2 - светло-зеленый.
Учитель. Посмотрите на физические свойства хозяйственного мыло. Щелочи так же мягкие и мылкие на ощупь, изменяют окраску индикаторов. Проведём эксперимент:
Фенолфталеин (бесцв.) + щёлочь -> малиновая окраска
Лакмус (фиолет.) + щёлочь -> синяя окраска
NaOH и КОН - сильные щелочи, при обращении с которыми необходимо соблюдать ТБ.
3. Способы получения оснований
А) Активный металл и вода
Б) основной оксид и вода
(Самостоятельно написать уравнения химических реакций)
4. Рассмотрим химические свойства оснований
А) с кислотами
Б) с кислотными оксидами
В) с амфотерными оксидами
Г) с растворимыми солями
Д) изменяют цвет индикаторов. (Дем. опыт)
А). Основание + кислота > соль + вода
(реакция обмена)
2NaOH + H 2 SO 4 -> Na 2 SO4 + 2H 2 O
OH - + H + -> H 2 O
Cu(OH) 2 + 2HCl -> CuCl 2 + 2H 2 O
Cu(OH) 2 + 2H + -> Cu +2 + 2H 2 O
Б) Основание + кислотный оксид -> соль + вода (реакция обмена)
Р 2 О 5 + 6КОН -> 2К 3 РО 4 + 3Н 2 О
Р 2 О 5 + 6OH - -> 2РО 4 3- + 3Н 2 О
2NaOH + N 2 O 5 -> 2NaNO 3 + Н 2 О
2OH - + N 2 O 5 -> 2NO 3 - + Н 2 О
Учитель. Взаимодействие щелочей с солями сопровождается образованием новой соли и нового основания и подчиняется закону Бертолле. Закон Бертолле основной закон направления обратимых хим. взаимодействий, который можно формулировать так: всякий химический процесс протекает в сторону максимального образования тех продуктов, которые во время реакции выходят из сферы взаимодействия.
В). Щёлочь + соль > новое основание + новая соль (реакция обмена)
Г). Нерастворимое основание -> оксид металла + вода (при t°С)
(реакция разложения)
Fe(OH) 2 -> FeO + H 2 O
Cu(OH) 2 -> CuO + H 2 O
Д) Изменяют цвет индикатор
5. ОСОБЫЕ СВОЙСТВА ОСНОВАНИЙ
1. Качественная реакция на Са(ОН) 2 - помутнение известковой воды:
Качественные реакции на ион Ва +2:
V. Закрепление изученного материала
Учитель. Для закрепления материала выполним задания.
1. По таблице растворимости солей, кислот и оснований в воде, найдите растворимые,труднорастворимые и малорастворимые основания.
2. Составьте молекулярные уравнения реакций:
3. Напишите уравнения реакций, характеризующие химические свойства гидроксида калия.
Учитель.Выполните тестовые задания:
1-вариант:
1. Формулы только оснований
приведены в ряду
а) Na 2 CO 3 , NaOH, NaCl
б) KNO 3 , HNO 3 , KОН
в) KОН, Mg(OH) 2 , Cu(OH) 2
г) HCl, BaCl 2 , Ba(OH) 2
2. Формулы только щелочей
приведены в ряду
а) Fe(OH) 3 , NaOH, Ca(OH) 2
б) KOH, LiOH, NaOH
в) KOH, Mg(OH) 2 , Cu(OH) 2
г) Al(OH) 3 , Fe(OH) 2 ,
Ba(OH) 2
3. Из указанных соединений
нерастворимым в воде основанием является
а) NaOH
б) Ва(ОН) 2
в) Fe(OH) 2
г) KOH
4. Из указанных соединений
щелочью является
а) Fe(OH) 2
б) LiOH
в) Mg(OH) 2
г) Cu(OH) 2
2-Вариант:
1. Металл, который, реагируя
с водой, образует щелочь, - это
а) железо
б) медь
в) калий
г) алюминий
2. Оксид, который при
взаимодействии с водой образует щелочь, - это
а) оксид алюминия
б) оксид лития
в) оксид свинца(II)
г) оксид марганца(II)
3. При взаимодействии
основного оксида с водой образуется основание
а) Аl(ОН) 3
б) Ва(ОН) 2
в) Cu(ОН) 2
г) Fe(OH) 3
4. Из перечисленных
уравнений химических реакций выберите уравнение
реакции обмена.
а) 2H 2 O = 2H 2 + O 2
б) HgCl 2 + Fe = FeCl 2 + Hg
в) ZnCl 2 + 2KOH = Zn(OH) 2 + 2KCl
г) CaO + CO 2 = CaCO 3
Ответы: 1-вариант: 1-В, 2-Б, 3-В, 4-Б.; 2-вариант:
1-В,2-Б,3-Б,4-В.
VI. Подведение итогов урока.
Учитель. Какой общий вывод можно сделать, изучив состав и свойства оснований?
Учащиеся делают вывод, что свойства оснований зависят от их строения, и записывают его в тетрадь.
Выставление оценок.
Домашнее задание .с.217-218 №1-5
2. ОСНОВАНИЯ
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (ОН -).
С точки зрения теории электролитической диссоциации это электролиты (вещества, растворы или расплавы которых проводят электрический ток), диссоциирующие в водных растворах на катионы металлов и анионы только гидроксид - ионов ОН - .
Растворимые в воде основания называются щелочами. К ним относятся основания, которые образованы металлами 1-й группы главной подгруппы (LiOH , NaOH и другие) и щелочноземельными металлами (Са (ОН) 2 , Sr (ОН) 2 , Ва (ОН) 2). Основания, образованные металлами других групп периодической системы в воде практически не растворяются. Щелочи в воде диссоциируют полностью:
NaOH ® Na + + OH - .
Многокислотные основания в воде диссоциируют ступенчато:
Ba ( OH) 2 ® BaOH + + OH - ,
Ba ( OH) + Ba 2+ + OH - .
C тупенчатой диссоциацией оснований объясняется образование основных солей.
Номенклатура оснований.
Основания называются следующим образом: сначала произносят слово «гидроксид », а затем металл, который его образует. Если металл имеет переменную валентность, то она указывается в названии.
КОН – гидроксид калия;
Ca ( OH ) 2 – гидроксид кальция;
Fe ( OH ) 2 – гидроксид железа ( II );
Fe ( OH ) 3 – гидроксид железа ( III );
При составлении формул оснований исходят из того, что молекула электронейтральна . Гидроксид – ион всегда имеет заряд (–1). В молекуле основания их число определяется положительным зарядом катиона металла. Гидрокогруппа заключается в круглые скобки, а выравнивающий заряды индекс ставится справа внизу за скобками:
Ca +2 (OH ) – 2 , Fe 3+( OH ) 3 - .
по следующим признакам:
1. По кислотности (по числу групп ОН - в молекуле основания): однокислотные – NaOH , KOH , многокислотные – Ca (OH ) 2 , Al (OH ) 3 .
2. По растворимости: растворимые (щелочи) – LiOH , KOH , нерастворимые – Cu (OH ) 2 , Al (OH ) 3 .
3. По силе (по степени диссоциации):
а) сильные (α = 100 %) – все растворимые основания NaOH , LiOH , Ba (OH ) 2 , малорастворимый Ca (OH ) 2 .
б) слабые (α < 100 %) – все нерастворимые основания Cu (OH ) 2 , Fe (OH ) 3 и растворимое NH 4 OH .
4. По химическим свойствам: основные – Са (ОН) 2 , Na ОН; амфотерные – Zn (ОН) 2 , Al (ОН) 3 .
Основания
Это гидроксиды щелочных и щелочноземельных металлов (и магния), а также металлов в минимальной степени окисления (если она имеет переменное значение).
Например: NaOH , LiOH , Mg ( OH ) 2 , Ca (OH ) 2 , Cr (OH ) 2 , Mn (OH ) 2 .
Получение
1. Взаимодействие активного металла с водой:
2Na + 2H 2 O → 2NaOH + H 2
Ca + 2H 2 O → Ca(OH) 2 + H 2
Mg + 2 H 2 O Mg( OH ) 2 + H 2
2. Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na 2 O + H 2 O → 2NaOH,
CaO + H 2 O → Ca(OH) 2 .
3. Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H 2 O 2NaOH + 2H 2 + CI 2
4. Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na 2 SO 4 + Ba (OH) 2 → 2NaOH + BaSO 4
MgSO 4 + 2NaOH → Mg(OH) 2 + Na 2 SO 4.
Физические свойства
Все основания являются твердыми веществами. В воде нерастворимы , кроме щелочей. Щелочи – это белые кристаллические вещества, мылкие на ощупь, вызывающие сильные ожоги при попадании на кожу. Поэтому они называются «едкими». При работе со щелочами необходимо соблюдать определенные правила и использовать индивидуальные средства защиты (очки, резиновые перчатки, пинцеты и др.).
Если щелочь попала на кожу необходимо промыть это место большим количеством воды до исчезновения мылкости, а затем нейтрализовать раствором борной кислоты.
Химические свойства
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид –
ионов ОН - .
1. Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый
2. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2NaOH + H 2 SO 4 → Na 2 SO 4 + 2H 2 O,
Растворимое
Cu( OH) 2 + 2HCI → CuCI 2 + 2H 2 O.
Нерастворимое
3. Взаимодействие с кислотными оксидами:
2 NaOH + SO 3 → Na 2 SO 4 + H 2 O
4. Взаимодействие с амфотерными оксидами и гидроксидами :
а) при плавлении:
2 NaOH + AI 2 O 3 2 NaAIO 2 + H 2 O ,
NaOH + AI(OH) 3 NaAIO 2 + 2H 2 O.
б ) в растворе :
2NaOH + AI 2 O 3 +3H 2 O → 2Na[ AI(OH) 4 ],
NaOH + AI(OH) 3 → Na.
5. Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H 2 O → Na 2 [ Zn(OH) 4 ] + H 2
2NaOH + Si + H 2 O → Na 2 SiO 3 + 2H 2
6. Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO 4 → Cu(OH) 2 + Na 2 SO 4 ,
Ba ( OH) 2 + K 2 SO 4 → BaSO 4 + 2KOH.
7. Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca( OH) 2 CaO + H 2 O,
Cu( OH) 2 CuO + H 2 O.
голубой цвет черный цвет
Амфотерные гидроксиды
Это гидроксиды металлов ( Be (OH ) 2 , AI (OH ) 3 , Zn (OH ) 2) и металлов в промежуточной степени окисления (С r (OH ) 3, Mn (OH ) 4).
Получение
Амфотерные гидроксиды получают взаимодействием растворимых солей со щелочами взятых в недостатке или эквивалентном количестве, т.к. в избытке они растворяются:
AICI 3 + 3NaOH → AI(OH) 3 +3NaCI.
Физические свойства
Это твердые вещества, практически нерастворимые в воде. Zn ( OH ) 2 – белый, Fe (ОН) 3 – бурый цвет.
Химические свойства
Амфотерные гидроксиды проявляют свойства оснований и кислот, поэтому взаимодействуют как с кислотами, так и с основаниями.
1. Взаимодействие с кислотами с образованием соли и воды:
Zn( OH) 2 + H 2 SO 4 → ZnSO 4 + 2H 2 O.
2. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды:

AI( OH) 3 + NaOH Na,
Fe 2 (SO 4) 3 + 3H 2 O,
2Fe( OH) 3 + Na 2 O 2NaFeO 2 + 3H 2 O.
Лабораторная работа № 2
Получение и химические свойства оснований
Цель работы : ознакомиться с химическими свойствами оснований и способами их получения.
Посуда и реактивы : пробирки, спиртовка. Набор индикаторов, магниевая лента, растворы солей алюминия, железа, меди, магния; щелочь(NaOH , К OH ), дистиллированная вода.
Опыт № 1. Взаимодействие металлов с водой.
В пробирку налить 3–5 см 3 воды и опустить в нее несколько кусочков мелко нарезанной магниевой ленты. Нагреть на спиртовке 3–5 мин, охладить и добавить туда 1–2 капли раствора фенолфталеина. Как изменился цвет индикатора? Сравнить с пунктом 1 на с. 27. Написать уравнение реакции. Какие металлы взаимодействуют с водой?
Опыт № 2. Получение и свойства нерастворимых
оснований
В пробирки с разбавленными растворами солей MgCI 2, FeCI 3 , CuSO 4 (5–6 капель) внести по 6–8 капель разбавленного раствора щелочи NaOH до образования осадков. Отметить их окраску. Записать уравнения реакций.
Разделить полученный синий осадок Cu (OH ) 2 на две пробирки. В одну из них добавить 2–3 капли разбавленного раствора кислоты, в другую _ столько же щелочи. В какой пробирке наблюдалось растворение осадка? Написать уравнение реакции.
Повторить этот опыт с двумя другими гидроксидами , полученными по обменным реакциям. Отметить наблюдаемые явления, записать уравнения реакций. Сделать общий вывод о способности оснований взаимодействовать с кислотами и щелочами.
Опыт№ 3. Получение и свойства амфотерных гидроксидов
Повторить предыдущий опыт с раствором соли алюминия ( AICI 3 или AI 2 (SO 4 ) 3). Наблюдать образование белого творожистого осадка гидроксида алюминия и растворение его при прибавлении как кислоты, так и щелочи. Записать уравнения реакций. Почему гидроксид алюминия обладает свойствами как кислоты, так и основания? Какие еще амфотерные гидроксиды вы знаете?
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое pH раствора, какими общими свойствами обладают кислоты и основания.
Как металлы и неметаллы, кислоты и основания - это разделение веществ по схожим свойствам. Первая теория кислот и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу - это класс веществ, которые в реакции с водой диссоциируют (распадаются), образовывая катион водорода H + . Основания Аррениуса в водном растворе образуют анионы OH - . Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания, соответственно, - это вещества, способные принять протон в реакции. Актуальная на данный момент теория - теория Льюиса. Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя аддукты Льюиса (аддукт - это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты - это распад HCl на H + и Cl - .
Свойства кислот и оснований
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется газ.
Часто используемые кислоты:
H 2 O, H 3 O + , CH 3 CO 2 H, H 2 SO 4 , HSO 4 − , HCl, CH 3 OH, NH 3
Часто используемые основания:
OH − , H 2 O, CH 3 CO 2 − , HSO 4 − , SO 4 2− , Cl −
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H + и анионы. Пример сильной кислоты - соляная кислота HCl:
HCl (р-р) + H 2 O (ж) → H 3 O + (р-р) + Cl - (р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO 3 , H 2 SO 4 , HClO 4
Список сильных кислот
- HCl - соляная кислота
- HBr - бромоводород
- HI - йодоводород
- HNO 3 - азотная кислота
- HClO 4 - хлорная кислота
- H 2 SO 4 - серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF (р-р) + H2O (ж) → H3O + (р-р) + F - (р-р) - в такой реакции более 90% кислоты не диссоциирует:
= < 0,01M для вещества 0,1М
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов, чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H 3 PO 4 фосфорная
- H 2 SO 3 сернистая
- H 2 S сероводородная
- H 2 CO 3 угольная
- H 2 SiO 3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH (р-р) + H 2 O ↔ NH 4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены, щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH) 2 гидроксид бария
- Ca(OH) 2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH - :
NH 3 (р-р) + H 2 O ↔ NH + 4 (р-р) + OH - (р-р)
Большинство слабых оснований - это анионы:
F - (р-р) + H 2 O ↔ HF (р-р) + OH - (р-р)
Список слабых оснований
- Mg(OH) 2 гидроксид магния
- Fe(OH) 2 гидроксид железа (II)
- Zn(OH) 2 гидроксид цинка
- NH 4 OH гидроксид аммония
- Fe(OH) 3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и основания, результирующий раствор будет нейтральным.
Пример:
H 3 O + + OH - ↔ 2H 2 O
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание (р-р) + H 2 O ↔ Слабая кислота (р-р) + OH - (р-р)
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства основания:
HX (р-р) + OH - (р-р) ↔ H 2 O + X - (р-р)
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
Диссоциация воды
Диссоциация - это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от равновесия, которое присутствует в воде:
H 2 O + H 2 O ↔ H 3 O + (р-р) + OH - (р-р)
K c = / 2
Константа равновесия воды при t=25°: K c = 1.83⋅10 -6 , также имеет место следующее равенство: = 10 -14 , что называется константой диссоциации воды. Для чистой воды = = 10 -7 , откуда -lg = 7.0.
Данная величина (-lg) называется pH - потенциал водорода. Если pH < 7, то вещество имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр - устройство, трансформирующее концентрацию протонов в растворе в электрический сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора, используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль - это ионное соединение образованное катионом отличным от H + и анионом отличным от O 2- . В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли , необходимо определить, какие ионы присутствуют в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH: не отдают ионы ни H + , ни OH - в воде. Например, Cl - , NO - 3 , SO 2- 4 , Li + , Na + , K + .
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F - , CH 3 COO - , CO 2- 3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора - количество сильной кислоты или сильного основания, которые можно добавить не повлияв на pH раствора
- Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Тест:
а) получение оснований .
1) Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как нерастворимые, так и растворимые основания:
CuSO 4 + 2 КОН = Сu(ОН) 2 + K 2 SO 4 ,
К 2 СО 3 + Ва(ОН) 2 = 2КОН + ВаСО 3 .
При получении этим методом растворимых оснований в осадок выпадает нерастворимая соль.
2) Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой:
2Li + 2Н 2 О = 2LiOH + H 2 ,
SrO + H 2 O = Sr(OH) 2 .
3) Щелочи в технике обычно получают электролизом водных растворов хлоридов:
б) химические свойства оснований .
1) Наиболее характерной реакцией оснований является их взаимодействие с кислотами - реакция нейтрализации. В нее вступают как щелочи, так и нерастворимые основания:
NaOH + HNO 3 = NaNO 3 + H 2 O,
Cu(OH) 2 + H 2 SO 4 = СuSО 4 + 2 H 2 O .
2) Выше было показано, как щелочи взаимодействуют с кислотными и амфотерными оксидами.
3) При взаимодействии щелочей с растворимыми солями образуется новая соль и новое основание. Такая реакция идет до конца только в том случае, когда хотя бы одно из полученных веществ выпадает в осадок.
FeCl 3 + 3 KOH = Fe(OH) 3 + 3 KCl
4) При нагревании большинство оснований, за исключением гидроксидов щелочных металлов, разлагаются на соответствующий оксид и воду:
2 Fе(ОН) 3 = Fе 2 О 3 + 3 Н 2 О,
Са(ОН) 2 = СаО + Н 2 О.
КИСЛОТЫ – сложные вещества, молекулы которых состоят из одного или нескольких атомов водорода и кислотного остатка. Состав кислот может быть выражен общей формулой Н х А, где А – кислотный остаток. Атомы водорода в кислотах способны замещаться или обмениваться на атомы металлов, при этом образуются соли.
Если кислота содержит один такой атом водорода, то это одноосновная кислота (HCl - соляная, HNO 3 - азотная, HСlO - хлорноватистая, CH 3 COOH - уксусная); два атома водорода - двухосновные кислоты: H 2 SO 4 – серная, H 2 S - сероводородная; три атома водорода - трехосновные: H 3 PO 4 – ортофосфорная, H 3 AsO 4 – ортомышьяковая.
В зависимости от состава кислотного остатка кислоты подразделяют на бескислородные (H 2 S, HBr, HI) и кислородсодержащие (H 3 PO 4 , H 2 SO 3 , H 2 CrO 4). В молекулах кислородсодержащих кислот атомы водорода связаны через кислород с центральным атомом: Н – О – Э. Названия бескислородных кислот образуются из корня русского названия неметалла, соединительной гласной -о - и слова «водородная» (H 2 S – сероводородная). Названия кислородсодержащим кислотам дают так: если неметалл (реже металл), входящий в состав кислотного остатка, находится в высшей степени окисления, то к корню русского названия элемента добавляют суффиксы -н- , -ев-, или -ов- и далее окончание -ая- (H 2 SO 4 – серная, H 2 CrO 4 - хромовая). Если степень окисления центрального атома ниже, то используется суффикс -ист- (H 2 SO 3 – сернистая). Если неметалл образует ряд кислот, используют и другие суффиксы (HClO – хлорноватист ая, HClO 2 – хлорист ая, HClO 3 – хлорноват ая, HClO 4 – хлорн ая).
С точки зрения теории электролитической
диссоциации, кислоты – электролиты,
диссоциирующие в водном растворе с
образованием в качестве катионов только
ионов водорода:
точки зрения теории электролитической
диссоциации, кислоты – электролиты,
диссоциирующие в водном растворе с
образованием в качестве катионов только
ионов водорода:
Н х А хН + +А х-
Наличием Н + -ионов обусловлено изменение окраски индикаторов в растворах кислот: лакмус (красный), метилоранж (розовый).
Получение и свойства кислот
а) получение кислот .
1) Бескислородные кислоты могут быть получены при непосредственном соединении неметаллов с водородом и последующим растворением соответствующих газов в воде:
2) Кислородсодержащие кислоты нередко могут быть получены при взаимодействии кислотных оксидов с водой.
3) Как бескислородные, так и кислородсодержащие кислоты можно получить по реакциям обмена между солями и другими кислотами:
ВаВr 2 + H 2 SO 4 = ВаSО 4 + 2 HBr ,
CuSO 4 + H 2 S = H 2 SO 4 + CuS ,
FeS+ H 2 SO 4 (paзб.) = H 2 S + FeSO 4 ,
NaCl (тв.)+ Н 2 SO 4 (конц.) = HCl + NaHSO 4 ,
AgNO 3 + HCl = AgCl + HNO 3 ,
4) В ряде случаев для получения кислот могут быть использованы окислительно-восстановительные реакции:
3Р + 5НNО 3 + 2Н 2 О = 3Н 3 РO 4 + 5NO
б) химические свойства кислот .
1) Кислоты взаимодействуют с основаниями и амфотерными гидроксидами. При этом практически нерастворимые кислоты (H 2 SiO 3 , H 3 BO 3) могут реагировать только с растворимыми щелочами.
H 2 SiO 3 +2NaOH=Na 2 SiO 3 +2H 2 O
2) Взаимодействие кислот с основными и амфотерными оксидами рассмотрено выше.
3) Взаимодействие кислот с солями – это обменная реакция с образованием соли и воды. Эта реакция идет до конца, если продуктом реакции является нерастворимое или летучее вещество, либо слабый электролит.
Ni 2 SiO 3 +2HCl=2NaCl+H 2 SiO 3
Na 2 CO 3 +H 2 SO 4 =Na 2 SO 4 +H 2 O+CO 2
4) Взаимодействие кислот с металлами – окислительно-восстановительный процесс. Восстановитель – металл, окислитель – ионы водорода (кислоты-неокислители: HCl, HBr, HI, H 2 SO 4(разбавл), H 3 PO 4) или анион кислотного остатка (кислоты-окислители: H 2 SO 4(конц) , HNO 3(конц и разб)). Продуктами реакции взаимодействия кислот-неокислителей с металлами, стоящими в ряду напряжений до водорода, являются соль и газообразный водород:
Zn+H 2 SO 4(разб) =ZnSO 4 +H 2
Zn+2HCl=ZnCl 2 +H 2
Кислоты окислители взаимодействуют почти со всеми металлами, включая и малоактивные (Cu, Hg, Ag), при этом образуются продукты восстановления аниона кислоты, соль и вода:
Сu + 2Н 2 SO 4 (конц.) = CuSO 4 + SO 2 + 2 Н 2 O,
Рb + 4НNО 3(конц) = Pb(NO 3) 2 +2NO 2 + 2Н 2 O
АМФОТЕРНЫЕ ГИДРОКСИДЫ проявляют кислотно-основную двойственность: с кислотами они реагируют как основания:
2Cr(OH) 3 + 3H 2 SO 4 = Cr 2 (SO 4) 3 + 6H 2 O,
а с основаниями – как кислоты:
Cr(OH) 3 + NaOH = Na (реакция протекает в растворе щелочи);
Сr(OH) 3 +NaOH =NaCrO 2 +2H 2 O (реакция протекает между твердыми веществами при сплавлении).
С сильными кислотами и основаниями амфотерные гидроксиды образуют соли.
Как и другие нерастворимые гидроксиды, амфотерные гидроксиды разлагаются при нагревании на оксид и воду:
Be(OH) 2 = BeO+H 2 O.
СОЛИ – ионные соединения, состоящие из катионов металлов (или аммония) и анионов кислотных остатков. Любую соль можно рассматривать как продукт реакции нейтрализации основания кислотой. В зависимости от того, в каком соотношении взяты кислота и основание, получаются соли: средние (ZnSO 4 , MgCl 2) – продукт полной нейтрализации основания кислотой, кислые (NaHCO 3 , KH 2 PO 4) – при избытке кислоты, основные (CuOHCl, AlOHSO 4) – при избытке основания.
Названия солей по международной номенклатуре образуют из двух слов: названия аниона кислоты в именительном падеже и катиона металла в родительном с указанием степени его окисления, если она переменная, римской цифрой в скобках. Например: Cr 2 (SO 4) 3 – сульфат хрома (III), AlCl 3 – хлорид алюминия. Названия кислых солей образуют добавлением слова гидро- или дигидро- (в зависимости от числа атомов водорода в гидроанионе): Ca(HCO 3) 2 – гидрокарбонат кальция, NaH 2 PO 4 - дигидрофосфат натрия. Названия основных солей образуют добавлением слова гидроксо- или дигидроксо- : (AlOH)Cl 2 – гидроксохлорид алюминия, 2 SO 4 - дигидроксосульфат хрома(III).
Получение и свойства солей
а) химические свойства солей .
1) Взаимодействие солей с металлами – окислительно-восстановительный процесс. При этом металл, стоящий левее в электрохимическом ряду напряжений, вытесняет последующие из растворов их солей:
Zn+CuSO 4 =ZnSO 4 +Cu
Щелочные и щелочноземельные металлы не используют для восстановления других металлов из водных растворов их солей, поскольку они взаимодействуют с водой, вытесняя водород:
2Na+2H 2 O=H 2 +2NaOH.
2) Взаимодействие солей с кислотами и щелочами было рассмотрено выше.
3) Взаимодействие солей между собой в растворе протекают необратимо лишь в том случае, если один из продуктов – малорастворимое вещество:
BaCl 2 +Na 2 SO 4 =BaSO 4 +2NaCl.
4) Гидролиз солей - обменное разложение некоторых солей водой. Гидролиз солей будет подробно рассмотрен в теме «электролитическая диссоциация».
б) способы получения солей .
В лабораторной практике обычно используют следующие способы получения солей, основанные на химических свойствах различных классов соединений и простых веществ:
1) Взаимодействие металлов с неметаллами:
Cu+Cl 2 =CuCl 2 ,
2) Взаимодействие металлов с растворами солей:
Fe+CuCl 2 =FeCl 2 +Cu.
3) Взаимодействие металлов с кислотами:
Fe+2HCl=FeCl 2 +H 2 .
4) Взаимодействие кислот с основаниями и амфотерными гидроксидами:
3HCl+Al(OH) 3 =AlCl 3 +3H 2 O.
5) Взаимодействие кислот с основными и амфотерными оксидами:
2HNO 3 +CuO=Cu(NO 3) 2 +2H 2 O.
6) Взаимодействие кислот с солями:
HCl+AgNO 3 =AgCl+HNO 3 .
7) Взаимодействие щелочей с солями в растворе:
3KOH+FeCl 3 =Fe(OH) 3 +3KCl.
8) Взаимодействие двух солей в растворе:
NaCl+AgNO 3 =NaNO 3 +AgCl.
9) Взаимодействие щелочей с кислотными и амфотерными оксидами:
Ca(OH) 2 +CO 2 =CaCO 3 +H 2 O.
10) Взаимодействие оксидов различного характера друг с другом:
CaO+CO 2 =CaCO 3 .
Соли встречаются в природе в виде минералов и горных пород, в растворенном состоянии в воде океанов и морей.
Один из классов сложных неорганических веществ - основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.
Строение
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований - Ме(ОН) х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH) 2 валентность магния - II, Al(OH) 3 валентность алюминия - III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH) 2 и Fe(OH) 3 . В таких случаях валентность указывается в скобках после названия - гидроксид железа (II), гидроксид железа (III).
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований - твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH) 2 - светло-зелёный, Fe(OH) 3 - красно-коричневый.

Рис. 1. Щёлочи в твёрдом состоянии.
Виды
Основания классифицируются по двум признакам:
- по количеству групп ОН - однокислотные и многокислотные;
- по растворимости в воде - щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами - литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs). Кроме того, к активным металлам, образующим щёлочи, относят щелочноземельные металлы - кальций (Ca), стронций (Sr) и барий (Ba).
Эти элементы образуют следующие основания:
- LiOH;
- NaOH;
- RbOH;
- CsOH;
- Ca(OH) 2 ;
- Sr(OH) 2 ;
- Ba(OH) 2 .
Все остальные основания, например, Mg(OH) 2 , Cu(OH) 2 , Al(OH) 3 , относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые - слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.

Рис. 2. Классификация оснований.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH) 2 , Al(OH) 3 , Pb(OH) 2 , Cr(OH) 3 , Be(OH) 2 и другие основания.
Получение
Основания получают различными способами. Самый простой - взаимодействие металла с водой:
Ba + 2H 2 O → Ba(OH) 2 + H 2 .
Щёлочи получают в результате взаимодействия оксида с водой:
Na 2 O + H 2 O → 2NaOH.
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO 4 + 2NaOH → Cu(OH) 2 ↓+ Na 2 SO 4 .
Химические свойства
Основные химические свойства оснований описаны в таблице.
|
Реакции |
Что образуется |
Примеры |
|
С кислотами |
Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами |
Cu(OH) 2 ↓ + H 2 SO 4 → CuSO 4 +2H 2 O |
|
Разложение при высокой температуре |
Оксид металла и вода |
2Fe(OH) 3 → Fe 2 O 3 + 3H 2 O |
|
С кислотными оксидами (реагируют щёлочи) |
NaOH + CO 2 → NaHCO 3 |
|
|
С неметаллами (вступают щёлочи) |
Соль и водород |
2NaOH + Si + H 2 O → Na 2 SiO 3 +H 2 |
|
Обмена с солями |
Гидроксид и соль |
Ba(OH) 2 + Na 2 SO 4 → 2NaOH + BaSO 4 ↓ |
|
Щелочей с некоторыми металлами |
Сложная соль и водород |
2Al + 2NaOH + 6H 2 O → 2Na + 3H 2 |
С помощью индикатора проводится тест на определение класса основания. При взаимодействии с основанием лакмус становится синим, фенолфталеин - малиновым, метилоранж - жёлтым.

Рис. 3. Реакция индикаторов на основания.
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания - сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи - более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Тест по теме
Оценка доклада
Средняя оценка: 4.5 . Всего получено оценок: 258.