Рибосома расходует на образование одной пептидной связи. Механизм образования пептидных связей в рибосоме. Методы определения пептидных связей
Аминокислоты способны соединяться между собой связями, которые называются пептидными , при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид ; если от 10 до 40 аминокислот – полипептид , если более 40 аминокислот – белок .
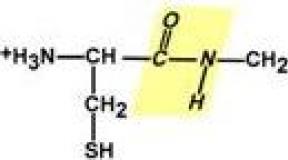
Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
Образование пептидной связи
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным. Например, аланил -серил -триптофан или γ-глутаминил -цистеинил -глици н (по-другому называемый глутатион ).
К свойствам пептидной связи относятся:
1. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.

2.Транс-положение заместителей
Радикалы аминокислот по отношению к оси пептидной C-N -связи находятся по "разные" стороны, в транс-положении.

3. Две равнозначные формы
Пептидная связь находится в кетоформе и енольной форме.

4. Способность к образованию водородных связей.
Атомы кислорода и водорода, входящие в пептидную группу, обладают способностью образовывать водородные связи с атомами кислорода и водорода других пептидных групп.

5. Пептидная связь имеет частично характер двойной связи.
Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
Трансляция
Общие сведения
Трансляция - это процесс, в результате которого рибосомы считывают генетическую информацию матричных РНК и создают белковый продукт в соответствии с этой информацией.
Специфические молекулы транспортрых РНК (тРНК) служат посредниками между кодом мРНК и конечной белковой последовательностью. В их состав входит последовательность, узнающая код мРНК и соответствующая этому коду аминокислота.
События трансляции разделяют на последующие события: инициацию, элонгацию и терминацию. На стадии инициации рибосома связывает мРНК и первая аминокислота присоединяется к рибосоме. Во время элонгации происходит рост полипептидной цепи. На стадии терминации рибосома отделяется от мРНК и процес трансляции заканчивается. У прокариот и эукариот процессы трансляции схожи, но имеются и существенные различия.
Трансляция происходит в цитоплазме, где находятся рибосомы. В зависимости от дальнейшего преднозначения синтезируемых белков, они могут образовываться либо в цитозоле, либо на поверхности шероховатого эндоплазматического ретикулума.
Полипептидные цепи синтезируются однонаправленно: с амино-конца к карбокси-концу.
При инициации первая и вторая молекулы аминоацил-тРНК спариваются с первыми двумя кодонами мРНК. Далее трансляция продолжается в направлении 5"–>3" кодон за кодоном до тех пор, пока не достигнет стоп-сигнала, расположенного сразу же за кодоном, детерминирующим С-концевую аминокислоту.
Литература:
Генетический код
Литература:
К сожалению, список литературы отсутствует.
Трансляция у эукариот
Вместо комплементарного РНК-РНК узнавания, в которое вовлечена прединициирующая последовательность Шайна-Дальгарно прокариотических мРНК, эукариотические мРНК узнаются эукариотическими рибосомами по кэпированному 5"-концу с обязательным участием белка, например, eIF-4F инициаторного фактора (Rhoads, 1988). Предполагается, что этот белок участвует в расплавлении вторичных структур 5"- областей мРНК, облегчая их связывание с малыми субчастицами рибосом. В отличие от прокариот, эукариотическая мРНК образует комплексы с белками (мРНП, или мессенджер-рибонуклеопротеиды, или информосомы), что обусловливает ее метаболическую стабильность. Вследствие этого у эукариот отсутствует постоянная интенсивная деградация и интенсивный ресинтез мРНК, которые, как правило, моноцистронны и имеют специфически модифицированный (кэпированный) 5"-конец. Все это обусловливает целый ряд особенностей инициации трансляции и ее регуляции у эукариотических организмов. Естественно, что метаболическая стабильность эукариотической мРНК делает регуляцию на уровне трансляции особенно важной в общей картине регуляции биосинтеза белка (Спирин, 1986).
Литература:
К сожалению, список литературы отсутствует.
Трансляция у прокариот
 Трансляция бактерии E.coli наиболее изучена
Трансляция бактерии E.coli наиболее изучена
Синтез белка происходит на рибонуклеопротеиновом комплексе - рибосоме, в процессе трансляции mRNA. Рибосома состоит из большой и малой субъединиц, которые соединены в области инициации трансляции (translation initiation region -TIR) mRNA во время стадии инициации трансляции. Во время элонгации рибосома скользит вдоль mRNA и синтезирует полипептидную цепь. Элонгация продолжается до тех пор, пока рибосома не достигает стоп-кодона на mRNA - терминация трансляции. После терминации рибосома отделяется от синтезированного полипептида и способна снова повторить цикл трансляции mRNA.
Каждая стадия трансляции имеет свои регуляторные факторы, но у эукариот этих факторов гораздо больше, чем у прокариот.
Инициация
Инициация
 Последовательность инициации трансляции у бактерии. 30S и 50S рибосомные субъединицы показаны светлым и темным серым цветом.
Последовательность инициации трансляции у бактерии. 30S и 50S рибосомные субъединицы показаны светлым и темным серым цветом.
Рибосомы прокариот инициируют трансляцию на мРНК уже во время транскрипции. Время необходимое для посадки рибосом порядка секунд, хотя это зависит от каждой мРНК. Рибосомы транслируют мРНК со скоростью приблизительно 12 аминокислот в секунду.
В инициации трансляции участвуют: рибосома, аминоацилированная и формилированная тРНК (fMet-tRNA f Met), мРНК и три белковых инициирующих фактора IF1, IF2 и IF3.
Бактериальная 70S рибосома состоит из большой 50S и малой 30S субъединицы. Имеется три tRNA связывающих сайта аминоацил - aminoacyl (A), пептидил - peptidyl (P), и сайт выхода - exit (E). Присоединение фактора IF3 к 30S рибосомной субъединице обеспечивает распад рибосомы на субъединицы. Фактор инициации IF1 связывается с A-сайтом 30S рибосомной субъединицы и служит инициатором присоединения tRNA к рибосомному P-сайту блокируя A-сайт. IF1 стимулирует активность IF3 и также распад рибосомных субъединиц.
После распада субъединиц, IF2, mRNA и fMet-tRNAfMet соединяются с 30S рибосомной субъединицей. Последовательность Шайно-Дальгарно (Shine-Dalgamo -SD) mRNA взаимодействует с anti-SD последовательностью 16S rRNA и инициирующий кодон присоединяется в Р-сайте рибосомы. Инициирующие факторы, особенно IF3, способствуют этому присоединению.
Инициаторная tRNA устанавливается в P-сайте 30S рибосомной субъединицы в три шага не зависимо от кодона, зависимо от кодона и fMet-tRNAfMet присоединение.
Все три шага обеспечиваются фактором IF2, который взаимодействует с fMet-tRNA f Met на рибосоме. IF3 стабилизирует присоединение fMet-tRNAfMet к рибосомному P-сайту и стабилизирует кодон-антикодон взаимодействие.
30S преинициаторный комплекс состояций из 30S рибосомной субъединицы, трех инициаторных факторов, mRNA в стартовой позиции, где fMet-tRNA f Met связана кодон независимо. Такой относительно нестабильный комплекс подвергается конформационному изменению, что обеспечивает кодон-антикодон взаимодействие и формирует более стабильный 30S инициаторный комплекс. Инициаторные факторы IF1 и IF3 отсоединяются, тогда как IF2 фактор стимулирует взаимодействие с 50S рибосомной субъединицей. После сборки рибосомы IF2 покидает комплекс. Во время этого процесса GTP связанный с IF2 гидролизуется до GDP и Pi. Вновь образованный 70S инициаторный комплекс, содержащий fMet-tRNA f Met как субстрат для пептидилтрансферазного центра 50S рибосомной субъединицы готов к вступлению в фазу элонгации трансляции.
Факторы инициации
: IF-1, IF-2, IF-3 - белки временно связывающиеся с рибосомой, необходимые для инициации.
Этапы инициации трансляции
1. Факторы инициации IF-1 и IF-3 связываются с 30S-субчастицей, что обеспечивает ее взаимодействие с IF-2, инициаторной формилметиониновой-тРНК (Fmet-тРНК F Met) и GTP.
2. При связывании инициаторных белков IF-1 и IF-2 с 30S-субчастицей происходит диссоциация 70S-рибосомы на две субъединицы.
3. Комплекс 30S-субъединицы со всеми факторами инициации и Fmet-тРНК F Met связывается с 5"-концом мРНК вблизи кодона AUG и узнает. AUG-кодон мРНК.
Связывание 30S-субчастицы с мРНК находится под строгим контролем нуклеотидной последовательности, расположенной примерно
за 10 нуклеотидов до 5"-конца инициаторного кодона. Взаимодействию способствует комплементарное спаривание этой богатой пуринами по следовательности из 5-8н, называемой последовательностью Шайна-Дальгарно
, с полипиримидиновым участком, находящимся вблизи 3"-конца 16S-pPHK.
4. Формирование полноценного функционального комплекса инициации завершается ассоциацией 50S-субчастицы с преинициаторным комплексом. При ассоциации 70S-рибосомы образуются два активных центра: Р- и А-участки. Fmet-TPHK F Met занимает Р-участок.
5. С образованием функциональной 70S-субчастицы отделяются все три белка инициации.
Элонгация
Факторы элонгации
: EF-Tu и EF-Ts - белки связывающиеся с рибосомой, необходимые для элонгации трансляции.
В процессе инициации образуется 70S-рибосома связанная с мРНК, в Р-центре которой находится Fmet-тPHK F Met
Для образования первой пептидной связи необходимо, чтобы
аминоацил-тРНК, соответствующая следующему кодону, заняла А-центр.
Этапы элонгации трансляции
:
1. EF-Tu-
GTP связывает все аминоацил-тРНК, кроме Fmet-тPHK F Met , и доставляет их к А-центру комплекса 70S-рибосома-мРНКАминоацил-тРНК связывает EF-Tu и GTP. Образовавшийся комплекс (аминоацил-тРНК-[ЕF-Тu-GТР]) доставляет аминоацил-тРНК к А-участку. GTP гидролизуется, и комплекс (EF-Tu-GDP) отделяется от рибосомы. EF-Ts
восстанавливает EF-Tu-GDP.
2. Когда оба участка, А и Р, заняты, пептидилтрансферазная активность 50S-субчастицы катализирует перенос группы Fmet с ее тРНК на аминогруппу аминоацил-тРНК, находящейся в А-участке. В результате в А-участке оказывается дипептидил-тРНК , а в Р – свободная тРНК.
3. тРНК освобождает Р-участок, образовавшаяся дипептидил-тРНК переместиться на него, а новый кодон должен быть готов к тому, чтобы занять освободившийся А-участок. Все эти процессы
осуществляются с помощью EF-G
при GTP-зависимой транслокации рибосомы.
4. Теперь новый кодон, занявший А-сайт, готов к спариванию с родственной аминоацил-тРНК. Сразу после связывания аминоацил-тРНК с А-
участком высвобождается комплекс EF-Tu-GDP и происходит регенерация функционально активного EF-Tu-GTP. При этом EF-Tu-GDP взаи- модействует с белком EF-Ts, что приводит к отделению GDP и образованию комплекса EF-Tu EF-Ts. Далее EF-Tu EF-Ts взаимодействует с GTP, происходит регенерация EF-Tu-GTP и отделение EF-Ts, и оба соединения оказываются готовыми к следую- щему циклу.
Для прочтения следующего кодона и удлинения полипептидной цепи еще на одну аминокислоту вся серия реакций должна повториться.
При образовании каждой пептидной связи расходуется энергия, равная четырем энергетическим эквивалентам (если за один эквивалент принять энергию образования фосфатной связи): два эквивалента АТР потребляются при аминоацилировании тРНК и два эквивалента GTP-
В каждом цикле элонгации.
2. При инициации трансляции IF-2 узнает Fmet-тРНКFMet среди всех других аминоацил-тРНК, a EF-Tu отличает met-тРНКF Met от
Fmet-тРНКM Met при внедрении в А-участок.
3. Факторы элонгации EF-Tu и EF-G то присоединяются, то отделяются от рибосомы в зависимости от того, связаны ли они с GTP или с GDP соответственно.
4. Растущая полипептидная цепь всегда соединена своим карбоксильным концом с тРНК, которая соответствует С-концевой аминокислоте в растущей полипептидной цепи.
5. Пептидилтрансфераза катализирует формирование пептидных связей между карбоксильным концом растущей цепи и аминогруппой аминоацил-тРНК.
Терминация
Факторы терминации:
RF-1
вызывает отделение полипептидной цепи при считывании кодонов UAA и UAG;
RF-2
действует аналогичным образом при считывании UAA и UGA,
EF-3
может облегчить работу двух других факторов.
Этапы терминации трансляции:
1. В А-участке оказывается один из трех терминирующих кодонов – UAG, UAA или UGA. Из-за отсутствия тРНК, отвечающих этим кодонам,полипептидил-тРНК остается связанной с Р-участком.
2. RF-1 и RF-2 катализируют отсоединение полипептидной цепи от тРНК, отделение их обоих от рибосомы, а 70S-рибосомы – от мРНК.
RF-1 узнает в А-участке кодон UAA или UAG; RF-2 включается в том случае, когда в А-участке оказы-вается UAA или UGA;
RF-3 облегчает работу двух других факторов. Если терминирующим кодономявляется UAA, то эффективность процесса терминации оказывается наибольшей, поскольку этот кодон узнают оба фактора – RF-1 и RF-2. Однако, каким бы из стоп-кодонов ни обеспечивалась терминация,ее эффективность зависит от фланкирующих эти кодоны последовательностей в мРНК.
Когда расстояние от рибосомы до сайта инициации достигнет величины 100–200 нуклеотидов, в этом сайте может произойти новая инициация трансляции. Таким образом на одной мРНК
может находится несколько транслирующих рибосом - полирибосомы
(рис)
Рибосомы
Характерискика рибосом
 Рибосомы
Рибосомы
эукариот
: 80S
, размер - 22x32 нм,
M ~4.5 млн.Да состоит из двух субъединиц.
Большая субъединица
М=3.0млн.Да, 60S
.
Малая субъединица
М=1.5 млн.Да, 40S
.
В цитоплазме эукариотической клетки содержится ~10 млн. рибосом
эукариотического типа.
Рибосомы прокариот
:
70S
, размер - 21x29 нм, М ~2.8 млн.Да,
состоит из двух субъединиц.
Большая субъединица
М=1.8млн.Да 50S
.
Малая субъединица
М=1.0млн.Да 30S
.
В клетке E.coli содержится ~15тыс. рибосом, что составляет
– 1/4 сухой массы клетки. Рибосомы прокариотического типа
присутствуют в митохондриях и пластидах эукариот.
Малые и большие субъединицы могут диссоциировать на составляющие
РНК и белки и самособираются при определенных условиях.
Строение рибосом
Рибосома имеет два участка для связывания тРНК:
Р-центр
(пептидил-тРНК-связывающий центр)
-
связывание тРНК присоединенной к растущей полипептидной
цепи.
А-центр
(аминоацил-тРНК-связывающий участок)
-
связвает тРНК несущую следующую добавляемую аминокислоту,
располагается на большой субъединице рибосомы.
Аcn
центр
пептидилтрансфераза
–
образует пептидные связи между актами, прочно связывается
с рибосомой.
рибосома
р эукариот 22x32 нм, M~4.5 млн.Да 80S. Большая субъед М=3.0млн.Да, 60S ; малая субъед М=1.5 млн.Да, 40S.
1rRNA18S (~2 тыс.н),~33 белка] | в цитоплазме Eu ~10 млн.р эукариотич типа |
р прокариот: 21x29 нм, М ~2.8 млн.Да, 70S | большая субъед М=1.8млн.Да 50S; малая субъед М=1.0млн.Да 30S | E.coli ~15тыс р – 1.4 сухой m кл | р прокариотич типа присут в митох и пластидах Eu |
| P-центр пептидил-тРНК-связывающий центр, А-центр большой субъед. р – аминоацил-тРНК-связывающий участок, Аcn центр | пептидилтрансфераза – образ. пептидные связи м-у актами, прочно связан с р | р прокариот мельче и сод меньше компонентов
мРНК [кэп | 5’-НТО | AUG | транслируемая область | стоп 3’-НТО | поли(А)]
инициация сканирование РНК малой субъединицой рибосомы | связывание со стартовым (инициирующим) кодоном AUG-5’ конца – сборка рибосомы | инициаторный комплекс, факторы инициации | Первой к мРНК присоед малая субъед. р связанная с инициаторной-тРНК узнающей AUG и несущей метионин. Процесс катализируется фактором инициации 2 IF2 – фосфорилирование одной из трех его субъед. снижает активность ф-та – контроль белкогого синтеза (незрелые эритроциты) | элонгация 5’?3’ | транслокация – возвращение пустой тРНК в цитоплазму | транслокация рибосомы вдоль мРНК сопровожд. конформационными изменениями с затратой энергии GTP (4GTP вцелом на 1 пепт. связь) | кодон мРНК спаривается с антикодоном тРНК | карбоксильный конец растущего полипептида связан ковалентно с тРНК – пептидил-тРНК | образ. полисомы | терминирующий кодон (стоп-кодон) UAA, UAG, UGA – диссоциация рибосомы – терминация | фактор освобождения-белок связ с стоп-кодоном и меняет активность пептидилтрансферазы кот присоед к пептидил-тРНК Н2О и полипептид отделяется от тРНК и выходит из р | Цикл элонгации составляет 1/20 сек – белок в 300 акт синтезируется за 20 сек Ecoli
Литература:
К сожалению, список литературы отсутствует.
Транспортная РНК
70-90Н | вторичная стр-ра- клеверный лист | CCA 3" const для всех tRNA |к концевому аденозину присоед акта |
наличие тимина, псевдоуридина-пси, дигироуридина ДГУ в D-петле - защита от рибонуклеаз? долгоживущие | Разнообразие первичных структур tРНК - 61+1 - по кол-ву кодонов + формилметиониновая tРНК, у кот антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур - 20 (по кол-ву аминокислот) | рекогниция - образование ковалентной связи м-у tРНК и актой | аминоацил-тРНК-синтетазы присоединяют акты к тРНК
Функция тРНК заключается в переносе аминокислот из цитоплазмы в рибосомы, в которых происходит синтез белков.
тРНК связывающие одну аминокислоту называются изоакцепторными.
Всего в клетке одновременно существует 64 различных тРНК.
Каждая тРНК спаривается только со своим кодоном.
Каждая тРНК распознает свой собственный кодон без участия аминокислоты. Связавшиеся с тРНК аминокислоты химически модифицировали, после чего анализировали получившийся полипептид, который содержал модифицированную аминокислоту. Цистеинил-тРНКCys (R=CH2-SH) восстанавливали до аланил-тРНКCys (R=CH3).
Большинство тРНК, не зависимо от их нуклеотидной последовательности, имеют вторичную структуру в форме клеверного листа из-за наличия в ней трех шпилек.
Особенности структуры тРНК
На 3"-конце молекулы всегда находятся четыре неспаренных нуклеотида, причем три из них – это обязательно ССА. 5"- и 3"-концы цепи РНК образуют акцепторный стебель. Цепи удерживают-ся вместе благодаря комплементарному спарива-нию семи нуклеотидов 5"-конца с семью нуклеотида-ми, находящимися вблизи 3"-конца. 2. У всех моле-кул имеется шпилька T?C, обозначаемая так пото-му, что она содержит два необычных остатка: рибо-тимидин (Т) и псевдоуридин (?). Шпилька состоит из двухцепочечного стебля из пяти спаренных осно- ваний, включая пару G-C, и петли длиной семь нуклеотидов. Тринуклеотид Т?С всегда расположен
в одном и том же месте петли. 3. В антикодоновой шпильке стебель всегда представлен семью спарен-
ными основаниями. Триплет, комплементарный родственному кодону,– антикодон – находится в пет-
ле, состоящей из семи нуклеотидов. С 5"-конца антикодон фланкируют инвариантный остаток ура-
цила и модифицированный цитозин, а к его 3"-концу примыкает модифицированный пурин, как правило
аденин. 4. Еще одна шпилька состоит из стебля длиной три-четыре пары нуклеотидов и петли варь-
ирующего размера, часто содержащей урацил в вос-становленной форме – дигидроурацил (DU). Наиболее сильно варьируют нуклеотидные по-следовательности стеблей, число нуклеотидов меж-ду антикодоновым стеблем и стеблем Т?С (вариа-бельная петля), а также размер петли и локализация остатков дигидроурацила в DU-петле.
[Сингер, 1998].
Третичная структура тРНК
L-образная структура.
Присоединение аминокислот к тРНК
 Для того чтобы аминокислота могла образовывать полипептидную цепь она должна присоединиться к тРНК с помощью фермента аминоацил-тРНК-синтетазы. Этот фермент образует ковалентную связь между карбоксильной группой аминокислоты и гидроксильной группой рибозы на 3’-конце тРНК при участии АТФ. Аминоацил-тРНК-синтетаза узнает специфический кодон не из-за наличия антикодона на тРНК, а по наличию специфического сайта узнавания на тРНК.
Для того чтобы аминокислота могла образовывать полипептидную цепь она должна присоединиться к тРНК с помощью фермента аминоацил-тРНК-синтетазы. Этот фермент образует ковалентную связь между карбоксильной группой аминокислоты и гидроксильной группой рибозы на 3’-конце тРНК при участии АТФ. Аминоацил-тРНК-синтетаза узнает специфический кодон не из-за наличия антикодона на тРНК, а по наличию специфического сайта узнавания на тРНК.
Всего в клетке имеется 21 различных аминоацил-тРНК-синтетаз.
Присоединение происходит в две стадии:
1. Карбоксильная группа аминокислоты присоединяется к а-фосфату АТФ. Полученный нестабильный аминоацил-аденилат стабилизируется связываясь с ферментом.
2. Перенос аминоацильной группы аминоацил-аденилата на 2’ или 3’-OH-группу концевой рибозы тРНК
Некоторые аминоацил-тРНК-синтетазы состоят из одной полипептидной цепи, другие – из двух или четырех идентичных цепей, каждая молекулярной массой от 35 до 115 кДа. Некоторые димерные и тетрамерные ферменты состоят из субъединиц двух типов. Четкой корреляции между размером молекулы фермента или характером его субъединичной структуры и специфичностью не существует.
Специфичность фермента определяется его прочным связыванием с акцепторным концом тРНК, DU-участком и вариабельной петлей. Некоторые ферменты, по-видимому, не распознают антикодоновый триплет и катализируют реакцию аминоацетилирования даже при измененном антикодоне. Однако отдельные ферменты проявляют пониженную активность по отношению к таким модифицированным тРНК и при замене антикодона присоединяют не ту аминокислоту.
70-90н | вторичная стр-ра- клеверный лист | CCA 3" const для всех tRNA |к концевому аденозину присоед акта |
наличие тимина, псевдоуридина-пси, дигироуридина ДГУ в D-петле - защита от рибонуклеаз? долгоживущие | Разнообразие первичных структур tРНК - 61+1 - по кол-ву кодонов + формилметиониновая tРНК, у кот антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур - 20 (по кол-ву аминокислот)
Имеются два вида тРНК связывающие метионин тРНКFMet и тРНКMMet у прокариот и, тРНКIMetи тРНКMMet - у эукариот. К каждой тРНК добавляется метионин с помощью соответствующих аминоацил-тРНК-синтетез. метионин присоединенный к тРНКFMet и тРНКIMet формилируется ферментом метионил-тРНК-трансформилазой до Fmet-тРНКFMet. тРНК нагруженные формилметионином узнают инициаторный кодон AUG.
Литература:
К сожалению, список литературы отсутствует.
Для перевода информации, записанной в виде последовательности нуклеотидов, на язык аминокислотной последовательности белка существует генетический код. Каждой аминокислоте соответствует три соседних нуклеотида (триплет, кодон ). Почти каждая из 20 протеиногенных аминокислот кодируется несколькими триплетами, т.е. генетический код вырожден . Генетический код универсален ; за редким исключением, у всех организмов одни и те же аминокислоты кодируются одинаковыми триплетами.
Для того, чтобы аминокислота использовалась рибосомами для синтеза белка, она должна быть присоединена к молекуле транспортной РНК (тРНК). Присоединение катализирует фермент аминоацил-тРНК-синтетаза. Аминокислота может присоединяться только к своей специфичной тРНК. Молекула тРНК имеет небольшие размеры (74-95 н.о.), образует характерную вторичную структуру в виде «клеверного листа» за счет внутрикомплементарных взаимодействий. Особый участок молекулы тРНК содержит антикодон – триплет, соответствующий акцептируемой аминокислоте и комплементарный кодону мРНК для этой аминокислоты (рис. 27). Молекула аминокислоты присоединяется к 3’-акцепторному концу своей молекулы тРНК с помощью фермента аминоацил-тРНК-синтетазы. То есть благодаря структуре молекулы тРНК каждая аминокислота приводится в соответствие определенному триплету. Таким образом, именно молекула тРНК является тем «переводчиком», который «расшифровывает» генетический код, переводя его в аминокислотную последовательность.
Рис. 27. Структура молекулы тРНК
Синтез белка происходит на рибосомах. Рибосома представляет собой сложный нуклеопротеидный комплекс, состоит из двух субъединиц, малой и большой.
Процесс синтеза белка включает три стадии: инициацию, элонгацию и терминацию. Рибосома связывается с мРНК и движется по ней до инициаторного кодона, с которого непосредственно начинается синтез белка. Инициаторным кодоном чаще всего служит AУГ-кодон (реже ГУГ или УУГ). Синтез полипептидной цепочки начинается с аминокислоты метионина. В инициации трансляции также принимает участие ряд белковых факторов и молекула ГТФ. После присоединения аминокислоты метионин рибосома движется по матрице, присоединяя последовательно аминокислотные остатки к растущей полипептидной цепочке. Схема элогационного цикла рибосомы, состоящего из процессов связывания, транспептидации и транслокации, представлена на рис. 28. Малая субъединица рибосомы содержит два участка связывания: А (аминоацил-тРНК-связывающий) и Р (пептидил-тРНК-связывающий). В А-участке происходит связывание молекулы тРНК, несущей аминокислоту, в Р-участке находится тРНК, связанная с растущей полипептидной цепочкой. На стадии связывания в А-участок поступает молекула тРНК, несущая аминокислоту, соответствующую кодону мРНК, находящемуся в этом участке. Антикодон тРНК соединяется с этим кодоном по принципу комплементарности. Связывание приводит к ситуации, когда вновь поступившая аминокислота сближается с растущей полипептидной цепочкой, находящейся в Р-участке. При этом большая субъединица рибосомы катализирует реакцию транспептидации (образование пептидной связи). В результате растущая полипептидная цепочка находится в А-участке (присоединена к вновь прибывшей молекуле РНК), чтобы освободить этот участок и поместить в него следующий кодон, происходит реакция транслокации. Свободная тРНК удаляется, а растущий полипептид перемещается в Р-участок. Рибосома переходит как бы в прежнее состояние, но на следующем кодоне матрицы. Трансляция всей молекулы белка представляет повторение таких циклов. В процессе элонгации принимают участие специальные белки, факторы элонгации (EF), и кроме того, процесс элонгации требует энергетических затрат. Для образования одной пептидной связи расходуется две молекулы ГТФ. (Энергия, запасенная в молекуле ГТФ, эквивалентна энергии молекулы АТФ).

Рис. 28. Схема элонгационного цикла рибосомы: А – аминоацил-тРНК-связывающий участок рибосомы, Р – пептидил-тРНК-связывающий участок рибосомы
При продвижении рибосомы освобождается 5¢-конец матрицы и на него может садиться следующая рибосома. Структура, в которой мРНК соединена с многими рибосомами, называется полисомой. Когда рибосома достигает стоп-кодона (УАА, УАГ или УГА), происходит терминация. Для терминации необходимы белковые факторы терминации, этот процесс сопровождается гидролизом ГТФ.
Курс «Молекулярные основы процессов жизнедеятельности»
УЧЕБНЫЙ ПЛАН КУРСА
№ газеты |
Учебный материал |
Лекция № 1. Основные виды биополимеров |
|
Лекция № 2. Внутримолекулярные и межмолекулярные взаимодействия в биополимерах |
|
Лекция № 3. Нуклеиновые
кислоты |
|
Лекция № 4. Механизмы функционирования белков |
|
Лекция № 5. Генетический
код |
|
Лекция № 6. Биосинтез нуклеиновых кислот |
|
Лекция № 7. Предварительные этапы биосинтеза белка |
|
Лекция № 8. Биосинтез белка и его локализация в клетке |
|
Итоговая
работа – разработка урока.
|
|
Лекция № 8. Биосинтез белка и его локализация в клетке
Следующим этапом биосинтеза белка является удлинение полипептидной цепи, или элонгация . Для этого этапа характерно, что в P-участке (пептидильном участке) присутствует тРНК с растущим пептидом. Напомню, что в конце инициации там оказалась инициаторная тРНК, несущая метионин, антикодон которой связан с инициаторным кодоном AUG. А-участок (аминоацильный участок) при этом свободен, а напротив него на мРНК имеется определенный кодон, следующий за AUG.
Пусть, например, это будет кодон UUC, кодирующий фенилаланин. Из цитоплазмы в А-участок рибосомы входят различные тРНК, несущие аминокислоты. Если антикодон тРНК комплементарен кодону на мРНК, тРНК прочно свяжется в А-участке, если же не комплементарен, то быстро выйдет оттуда. В нашем случае в А-участке будет связана тРНК с антикодоном GAA, несущая фенилаланин.
Этот процесс дополнительно ускоряется, и точность его увеличивается благодаря участию белка, называемого фактором элонгации-1. Если в А-участке связана правильная тРНК, то он закрепляет ее там, используя энергию гидролиза молекулы ГТФ. После этого фактор элонгации-1, связанный с ГДФ, уходит из рибосомы, а тРНК с фенилаланином остается прочно связанной. Аминоацил-тРНК при этом будет связана с рибосомой тремя участками: антикодоновой петлей – с кодоном мРНК, средней частью – с малой субъединицей и концом, несущим аминокислоту, с большой субъединицей. Такое связывание очень прочно и аминоацил-тРНК практически уже не может освободиться из А-участка.
Теперь, когда инициаторная тРНК с метионином занимает P-участок, а вторая тРНК с фенилаланином прочно связалась в А-участке, их 3"-концы оказываются сближенными в районе пептидилтрансферазного центра рибосомы. Напомню, что этот центр осуществляет перенос пептидного остатка на аминогруппу аминоацил-тРНК. В данном случае пептидным остатком является остаток метионина, принесенной инициаторной тРНК. После такого переноса карбоксильная группа метионина образует пептидную связь с аминогруппой фенилаланина (рис. 1).
Важно отметить, что энергии, запасенной в связи метионина с тРНК, с большим избытком хватает на образование пептидной связи: энергия гидролиза связи аминокислоты с тРНК составляет около 30 кДж/моль, а энергия гидролиза пептидной связи всего 2 кДж/моль.
После переноса остатка фенилаланина в P-участке остается инициаторная тРНК, не связанная с аминокислотой, а в А-участке – фенилаланиновая тРНК, к 3"-концу которой присоединен дипептид метионилфенилаланин. Аминокислота, пришедшая в рибосому первой (метионин), оказывается на свободном N-конце пептида, а пришедшая второй (фенилаланин) – присоединенной к 3"-концу тРНК.
Такое положение компонентов не соответствует функциям связывающих центров рибосомы, поэтому энергетически выгодным становится перемещение отдельных компонентов в рибосоме. Косвенно оно обеспечено энергией расщепления связи метионина с тРНК. Это перемещение носит название стадии транслокации .
В искусственных системах биосинтеза белка in vitro оно может происходить самопроизвольно, но с низкой скоростью. По-видимому, у такого перемещения существует довольно высокий энергетический барьер, поэтому в живой клетке для ускорения этого процесса используется энергия еще одной макроэргической связи, которую приносит молекула ГТФ.
Сама рибосома не может использовать ГТФ, однако она имеет центр связывания вспомогательных белков. В транслокации участвует белок, называемый фактором элонгации-2. Используя энергию гидролиза ГТФ, он перемещает связанные с рибосомой компоненты. При этом тРНК, несущая пептид, занимает P-участок, вытесняя оттуда пустую тРНК. Эта тРНК покидает рибосому и может присоединить новую аминокислоту. Вместе с тРНК перемещается и мРНК, при этом связь мРНК с пептидил-тРНК сохраняется, и в P-участке оказывается тРНК, связанная с комплементарным ей кодоном. В А-участке же никакой тРНК не будет, а напротив него окажется следующий кодон мРНК.
Таким образом, повторяется ситуация, которая была в начале элонгации. Теперь в А-участок поступит следующая аминоацил-тРНК, антикодон которой комплементарен кодону в А-участке. Например, если в А-участке окажется кодон CCG, с ним свяжется тРНК с антикодоном CGG, несущая пролин, а если кодон UAC, то свяжется тРНК с антикодоном GUA, несущая тирозин. Так же, как и в случае с первой тРНК, несущей фенилаланин, этот процесс идет с участием фактора элонгации-1 и сопровождается гидролизом ГТФ.
Пусть кодон на мРНК будет UCG и в А-участке будет тРНК с антикодоном CGA. Принесенная этой тРНК аминокислота (серин) попадает в пептидилтрансферазный центр, который осуществляет перенос дипептида метионил-фенилаланина из P-участка на аминогруппу серина. В результате в А-участке окажется тРНК, несущая трипептид метионил-фенилаланил-серин, а в P-участке – свободная тРНК.
Как и после образования первой пептидной связи, такое состояние энергетически невыгодно, поэтому снова происходит транслокация с участием фактора элонгации-2, сопровождающаяся гидролизом ГТФ. После транслокации тРНК с трипептидом окажется в P-участке, а А-участок будет свободен, и весь процесс повторится.

Последовательность процессов присоединения аминоацил-тРНК к А-участку, образования пептидной связи и транслокации называется элонгационным циклом (рис. 2). Для протекания этого процесса не важна природа аминокислот, а необходима только комплементарность кодона на мРНК и антикодона тРНК. Таким образом, повторяя элонгационный цикл, рибосома может синтезировать любой белок, последовательность которого будет определяться только последовательностью нуклеотидов в мРНК. При этом пришедший первым остаток метионина всегда будет находиться на свободном N-конце синтезируемого пептида, а остаток аминокислоты, пришедший последним, окажется прикрепленным к 3"-концу тРНК.
Часто на одной мРНК последовательно друг за другом синтезируют белок несколько рибосом. Это позволяет более эффективно использовать мРНК и синтезировать в единицу времени больше белковых молекул. Такие структуры, состоящие из одной мРНК и нескольких работающих на ней рибосом, называются полисомами (рис. 3).

Образование каждой пептидной связи в рибосоме сопровождается гидролизом двух молекул ГТФ и, кроме того, рибосома использует энергию связи аминокислоты с тРНК, на образование которой было израсходовано две макроэргические связи АТФ. Таким образом, процесс биосинтеза белка с точки зрения энергетики очень расточителен: затрачивается около 120 кДж/моль образовавшихся связей, а полезная работа (включая энергию пептидной связи, транслокацию и уменьшение энтропии) составляет около 12 кДж/моль. Такой большой расход энергии обеспечивает высокую скорость протекания процесса биосинтеза белка и его устойчивость к воздействию различных неблагоприятных факторов.
Процесс элонгации продолжается до тех пор, пока в А-участок не попадет стоп-кодон, для которого в клетке нет тРНК с комплементарным кодоном. Напомним, что стоп-кодонами являются кодоны UAA, UAG, UGA. На этих кодонах процесс элонгации останавливается и начинается завершающий этап биосинтеза белка, называемый терминацией.
В действие вступают вспомогательные белки, называемые факторами терминации . У эукариот такой фактор один, а у прокариот – несколько. Эти белки узнают стоп-кодоны и связываются в рибосоме вместо тРНК в А-участке. При этом они подставляют в пептидилтрансферазный центр рибосомы молекулу воды, на которую и переносится синтезированный пептид, т.е. происходит гидролиз связи синтезированного пептида с тРНК.
Это приводит к тому, что освободившаяся тРНК покидает рибосому, а образовавшийся пептид освобождается и начинает самостоятельное существование. Рибосома обычно диссоциирует на субъединицы и освобождает мРНК. Однако у прокариот на полицистронных матрицах часто рибосома, продвинувшись по мРНК до начала участка, кодирующего следующий белок, инициирует синтез на той же мРНК.
Пептид, синтезируемый рибосомой, часто уже в процессе биосинтеза приобретает свойственную ему вторичную и третичную структуру и может проявлять свою биологическую активность. В других случаях белок принимает свойственную ему конформацию, только освободившись из рибосомы. Третья группа белков требует для своего правильного сворачивания вспомогательных белков, называемых шаперонами.
Однако часто образованный на рибосоме пептид не активен. Для образования активного белка часто требуется его последующая модификация. Этот процесс получил название созревания белка . Он может включать в себя различные процессы.
Во-первых, почти всегда от белка отщепляется первый остаток метионина, с которого начинался его синтез. Часто кроме него отщепляется еще несколько аминокислот. Иногда выщепляются участки из середины полипептидной цепи, тогда готовый белок, синтезированный в виде одной полипептидной цепочки на одной мРНК, превращается в белок, состоящий из двух субъединиц. Кроме того, могут происходить химические модификации отдельных аминокислотных остатков.
Наиболее частые модификации – присоединение фосфорной кислоты к остаткам серина, треонина и тирозина, метилирование аминогрупп лизина и гистидина, окисление пролина. Но наиболее заметными модификациями белков является их гликозилирование, т.е. присоединение к ним моно- или олигосахаридов.
Особенно часто такие модификации встречаются у белков эукариот. В некоторых случаях масса присоединенных углеводных остатков сравнима с массой самого белка. В наибольшей степени гликозилированы белки, находящиеся на поверхности клеток или выделяемые клетками в окружающую среду. Такая модификация делает белок более устойчивым к различным денатурирующим факторам и действию протеолитических ферментов. Кроме того, углеводные группы на поверхностных белках клеток играют важную роль в межклеточном узнавании.
Следует отдельно остановиться на синтезе белков клеточных органелл и мембран. Такие белки не могут образовываться в цитоплазме, т.к. они нерастворимы и образовали бы агрегаты. Поэтому в мРНК для таких белков закодирована специальная аминокислотная последовательность, называемая сигнальным пептидом. Она располагается на N-конце белка, т.е. синтезируется первой. Как только сигнальный пептид высунется из рибосомы, с ним связывается специальный комплекс РНК и белков, называемый SRP-частицей. Эта частица связывается также и с рибосомой, не давая ей синтезировать белок дальше.
Затем комплекс «рибосома-SRP-частица» находит в мембранах эндоплазматического ретикулума специальный белковый комплекс, который имеет высокое сродство к рибосоме и сигнальному пептиду. Он вытесняет SRP-частицу и связывает рибосому таким образом, что синтезируемый пептид по специальному каналу проходит внутрь мембраны. Если синтезируется мембранный белок, то он в процессе синтеза встраивается в мембрану. Если же синтезируемый белок должен попасть внутрь органеллы или выйти из клетки, то он проходит по каналу на другую строну мембраны.
После того, как сигнальный пептид прошел сквозь мембрану, он расщепляется. Оставшийся белок обычно гликозилируется, а если это мембранный белок, к нему часто присоединяются остатки жирных кислот или углеводородные радикалы.
Для разной локализации в клетке существуют разные сигнальные последовательности. Связывающие рибосомы комплексы на мембранах эндоплазматического ретикулума обычно концентрируются в определенных участках мембраны. К этим участкам присоединяется одновременно большое число рибосом. В электронном микроскопе такие участки мембран выглядят как шероховатый ретикулум.
Несмотря на общность механизмов биосинтеза белка у разных организмов, надо отметить, что рибосомы и другие компоненты белоксинтезирующего аппарата несколько отличаются у прокариот и эукариот. На этом основано специфическое ингибирование биосинтеза белка у бактерий под действием некоторых веществ, прежде всего антибиотиков. Примерно половина всех известных антибактериальных антибиотиков действует на рибосомы бактерий и не действует на рибосомы животных. К таким антибиотикам относятся тетрациклин, хлорамфеникол (левомицетин), эритромицин и многие другие.
Вопросы для самостоятельной работы
1. Какие взаимодействия удерживают аминоацил-тРНК в А-участке?
2. Откуда берется и на что расходуется энергия в процессе биосинтеза белка? Каков коэффициент полезного действия этого процесса?
3. Какие белковые факторы участвуют в биосинтезе белка? Каковы их функции?
4. Что такое созревание белка?
5. Где происходит синтез мембранных белков?
6. Что определяет локализацию синтезированного белка в клетке?
Литература
Спирин А.С. Принципы функционирования рибосом // Соросовский Образовательный Журнал. 1999. №4. С. 2–9.
Спирин А.С. Биосинтез белка: элонгация полипептида и терминация трансляции // Соросовский Образовательный Журнал. 1999. № 6. С. 2–7.
Итговая работа
Подготовьте материалы для проведения урока по одной из следующих тем.
1. Строение и функции белков.
2. Строение и биосинтез нуклеиновых кислот.
3. Матричный синтез биополимеров. Генетический код.
4. Биосинтез белка на рибосоме.
Материалы должны содержать лекцию (на 25–30 мин), контрольные вопросы для устного ответа учащихся на уроке и тесты (5–8 с одним правильным вариантом ответа и 3–5 с несколькими правильными вариантами ответов) для письменной проверки знаний всех учащихся класса.
Работа должна быть отпечатана на компьютере или пишущей машинке на стандартных листах формата А4. Стиль изложения свободный. Объем материала не ограничен.
Итоговая работа должна быть отправлена в «Педагогический университет» не позднее 28 февраля 2005 г.
Элонгация, образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация. Роль белковых факторов на каждой из стадий трансляции
По завершении инициации рибосома располагается на мРНК таким образом, что в Р-центре находится инициирующий кодон AUG с присоединённой к нему Мет-тРНКшМет, а в А- центре - триплет, кодирующий включение первой аминокислоты синтезируемого белка. Далее начинается самый продолжительный этап белкового синтеза - элонгация, в ходе которого рибосома с помощью аа-тРНК последовательно "читает" мРНК в виде триплетов нуклеоти-дов, следующих за инициирующим кодоном в направлении от 5" к 3"-концу, наращивая полипептидную цепочку за счёт последовательного присоединения аминокислот.
Включение каждой аминокислоты в белок происходит в 3 стадии, в ходе которых: 1)аа-тРНК каждой входящей в белок аминокислоты связывается с А-центром рибосомы; 2)пептид от пептидил-тРНК, находящейся в Р-центре, присоединяется к б-NH2-гpyппe аминоацильного остатка аа-тРНК А-центра с образованием новой пептидной связи; 3)удлинённая на один аминокислотный остаток пептидил-тРНК перемещается из А-центра в Р-центр в результате транслокации рибосомы.
Связывание аминоацил-тРНК в А-центре. Кодон мРНК, располагающийся в А-центре рядом с инициирующим кодоном, определяет природу аа1тРНКaa1, которая будет включена в А-центр. аа1тРНКaa1 взаимодействует с рибосомой в виде тройного комплекса, состоящего из фактора элонгации EF-1, аа1тРНКaa1 и ГТФ. Комплекс эффективно взаимодействует с рибосомой лишь в том случае, если антикодон аа-тРНКaa1 комплементарен и антипараллелен ко-дону мРНК в А-центре. Включение аа-тРНКaa1 в рибосому происходит за счёт энергии гидролиза ГТФ до ГДФ и неорганического фосфата. Образование пептидной связи происходит сразу же после отщепления комплекса EF-1 и ГДФ от рибосомы. Эта стадия процесса получила название реакции транспептидации
В ходе этой реакции остаток метионина Мет-тРНКIМет связывается с a-аминогруппой первой аминокислоты, присоединённой к тРНКaa1 и расположенной в А-центре, образуется первая пептидная связь.
Транслокация - третья стадия элонгации. К рибосоме присоединяется фактор элонгации EF-2 и за счёт энергии ГТФ продвигает рибосому по мРНК на один кодон к 3"-концу. В результате дипептидил-тРНК, которая не меняет своего положения относительно мРНК, из А-центра перемещается в Р-центр. Свободная от метионина тРНКiМет покидает рибосому, а в область А-центра попадает следующий кодон.
По завершении третьей стадии элонгации рибосома в Р-центре имеет дипептидил-тРНК, а в А-центр попадает триплет, кодирующий включение в полипептидную цепь второй аминокислоты. Начинается следующий цикл стадии элонгации, в ходе которого на рибосоме снова проходят вышеописанные события. Повторение таких циклов по числу смысловых кодонов мРНК завершает весь этап элонгации.
Терминация трансляции наступает в том случае, когда в А-центр рибосомы попадает один из стоп-кодонов: UAG, UAA или UGA. Для стоп-кодонов нет соответствующих тРНК. Вместо этого к рибосоме присоединяются 2 белковых высвобождающих фактора RF или фактора терминации. Один из них с помощью пептидилтрансферазного центра катализирует гидролитическое отщепление синтезированного пептида от тРНК. Другой за счёт энергии гидролиза ГТФ вызывает диссоциацию рибосомы на субъединицы
Таким образом, матричная природа процесса трансляции проявляется в том, что последовательность поступления аминоацил-тРНК в рибосому для синтеза белка строго детерминирована мРНК, т.е. порядок расположения кодонов вдоль цепи мРНК однозначно задаёт структуру синтезируемого белка. Рибосома сканирует цепь мРНК в виде триплетов и последовательно отбирает из окружающей среды "нужные" аа-тРНК, освобождая в ходе элонгации деацилированные тРНК.
Малая и большая субъединицы рибосомы в процессе трансляции выполняют разные функции: малая субъединица присоединяет мРНК и декодирует информацию с помощью тРНК и механизма транслокации, а большая субъединица ответственна за образование пептидных связей.